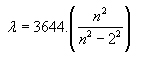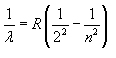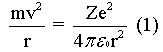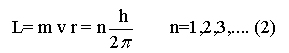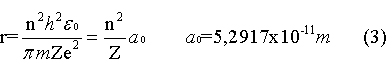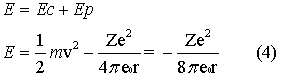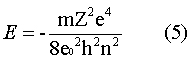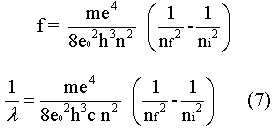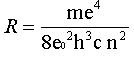|
1.
MODELOS ATÔMICOS
1.1 Espectros de emissão
de gases monoatômicos |
|
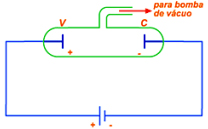 Figura 1: Esquema do equipamento utilizado para obtenção da descarga elétrica em gases. Fonte: http://www.passeiweb.com/na_ponta_lingua/sala_de_aula/fisica/fisica_moderna/eletricidade/gases_eletricidade |
|
A diferença de potencial entre os eletrodos pode atingir alguns milhares de volts para tubos de cerca de 30 cm. À medida que diminui a pressão, a luz emitida apresenta cores que dependem da natureza do gás. Esse fato foi verificado quando a luz emitida pelo tubo passou a ser analisada através de espectroscópios. Os espectroscópios do século XIX (Figura 2) eram constituídos por prismas dispersores ou redes de difração que separavam as diferentes cores emitidas pelo gás, isto é, os diferentes comprimentos de onda emitidos. Ao conjunto de comprimentos de onda emitidos pelo gás foi dado o nome de espectro de emissão. Alguns comprimentos de onda não são visíveis, mas podiam ser registrados em chapas fotográficas.
A figura 3 mostra um espectroscópio utilizado
hoje nos laboratórios de espectroscopia. Uma rede de difração
substitui o prisma. O espectro pode ser projetado numa escala graduada
(figura 4) para que o comprimento de onda de cada linha seja determinado
pela sua posição em relação à
fonte de luz. Para uma medida mais precisa, são utilizados
foto sensores ao longo da escala, que além de medir a posição
da linha, também podem medir sua intensidade.
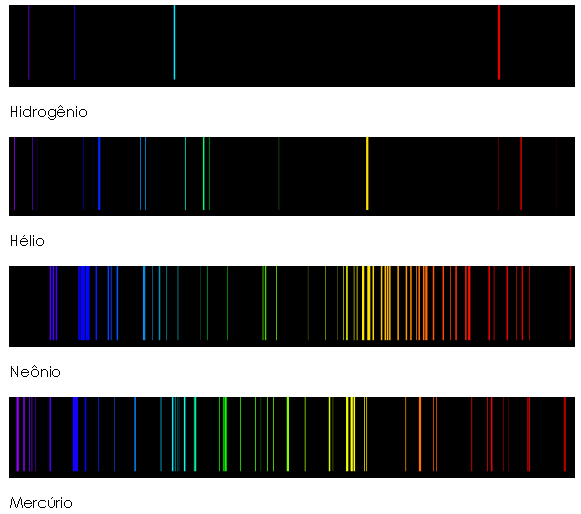
Diferente de um metal incandescente que emite um espectro contínuo, gases parcialmente ionizados gerados de descargas elétricas emitem espectros discretos, isto é, somente alguns comprimentos de onda são emitidos de modo que a aparência do espectro observado é um conjunto de linhas. A cada elemento, no estado atômico, corresponde um espectro de linhas que o caracteriza, isto é, a localização (comprimento de onda) e o número de linhas diferem de elemento para elemento. A figura 5 mostra a configuração de alguns espectros de emissão de gases monoatômicos, também conhecidos como espectro de linhas devido a sua forma.
Figura 5: Espectro de linhas de gases monoatômicos. Fonte: http://jersey.uoregon.edu/vlab/elements/Elements.html Como cada elemento químico é caracterizado por um espectro, como se fosse sua impressão digital, vários espectroscopistas do século XIX passaram a escrever fórmulas empíricas para determinar os comprimentos de onda das linhas espectrais dos elementos analisados. A fórmula empírica para as linhas visíveis do hidrogênio, elemento mais simples da natureza por possuir Z=1, foi obtida por Johann Jakob Balmer em 1885. A série de comprimentos de onda calculados pela fórmula ficou conhecida por Série de Balmer e a expressão é a seguinte, em angstroms (10-10m):
Nessa fórmula empírica, é o comprimento
de onda da linha de número n do espectro do hidrogênio,
n é um inteiro igual ou maior que 3 e R é uma constante
conhecida como constante de Rydberg, dada por
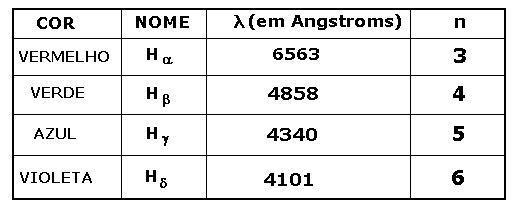
A tabela 1 mostra as cores das linhas visíveis
do hidrogênio, o comprimento de onda correspondente e o n
associado a cada linha.
Outras séries empíricas foram formuladas na mesma época para calcular as linhas emitidas na região do infravermelho e também ultravioleta. São elas:
Não havia uma justificativa física para
essas fórmulas, isto é, não era possível
explicar porque os espectros mudavam tanto de um elemento para outro
e porque seguiam fórmulas com formatos parecidos. Porém,
era consenso que esses resultados eram consequência de uma
estrutura bem definida para o átomo quanto ao comportamento
dos elétrons em seu interior, já que a absorção
e emissão de radiação eletromagnética
deveriam relacionar-se com a movimentação de cargas
elétricas (segundo a teoria
eletromagnética clássica de Maxwell). Na
década de 1910, a teoria de Planck para a radiação
do corpo negro e o Efeito Fotoelétrico eram bem conhecidos
e ambos usavam o conceito de quanta
de energia. Em 1913, Neils Bohr utilizou o conceito de
quanta e os resultados do espectro do hidrogênio para propor
um modelo atômico que contemplava o comportamento do elétron.
Vejamos a proposta de Bohr. (QUANTA..., 2009). |
1.2 Modelo de Bohr para o átomo de hidrogênio: O salto quântico O ponto de partida de Bohr foi o modelo de Rutherford, no qual a massa positiva estava concentrada no núcleo e os elétrons giravam em torno dele devido à força elétrica, em qualquer raio, veja figura 6. A equação 1 mostra a igualdade entre a força centrípeta e a força elétrica. Pela teoria eletromagnética clássica de Maxwell, o elétron acelerado por uma força centrípeta deveria emitir radiação eletromagnética constantemente, isto é, perderia energia e consequentemente iria mover-se em espiral até atingir o núcleo. Então, o átomo seria instável!. (TEORIA..., 2009).
Figura 6: Elétron executando uma órbita
circular de raio r sob a ação da força elétrica
de atração. Fonte: http://www.fisica.ufs.br/CorpoDocente/egsantana/elecmagnet/movimiento/bohr/bohr.htm Os resultados experimentais mostravam que as radiações
emitidas tinham um caráter descontínuo com linhas
bem definidas e cujos comprimentos de onda estavam relacionados
a números inteiros n (ver fórmulas empíricas).
n é um número inteiro
que é denominado número quântico, e h
é a constante de Planck, 6.6256 x10-34 Js.
onde a0 é o raio
de Bohr, o raio da órbita do elétron do átomo
de Hidrogênio (Z=1) em seu estado fundamental
n =1.
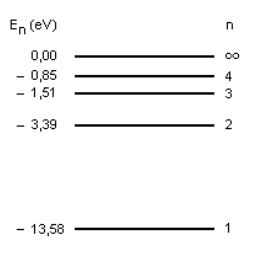
A equação 5 mostra que a energia do elétron aumenta com o número quântico n e a figura 7 mostra alguns estados de energia permitidos em elétron volt. Note, na equação 5, que se n é muito grande, a energia tende a zero. Os estados de energia permitidos foram chamados de estados estacionários.
Postulado 2 - A radiação
eletromagnética é emitida em forma de um fóton
de energia E=h.f somente quando o elétron salta de um estado
estacionário para outro mais interno, sendo a energia irradiada
dada por |
|
onde h é a constante de Planck (6.63 x 10-34 J.s = 4.14 x 10-15 ev.s), f é a frequência da radiação emitida, Ei e Ef são energias dos estados inicial e final. A partir das equações 4 e 5, podemos calcular a frequência ou o inverso do comprimento de onda do fóton emitido. |
|
A equação 7 tem a mesma forma das
fórmulas empíricas para as linhas espectrais. Isto
é, as séries espectrais são exatamente transições
do elétron entre níveis estacionários (órbitas
permitidas pelo primeiro postulado) do átomo de hidrogênio.
As linhas da série de Lyman são transições
dos níveis com n maior ou igual a 2 para o nível
1. Transições dos níveis com n maior ou igual
a 3 para o nível 2 fornecem a série de Balmer. A
série de Paschen resulta de transições para
o nível 3 e a de Brackett para o nível 4.
Dessa forma, os postulados de Bohr retiraram
a instabilidade do átomo, já que o elétron
não pode irradiar energia enquanto encontra-se numa órbita
permitida, e ainda explicaram os resultados obtidos para o espectro
do hidrogênio, pois os comprimentos de onda das linhas espectrais
coincidem com os valores previstos pela equação
7.
|