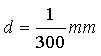AVALIAÇÃO
COMO MEIO PARA
A PRODUÇÃO DE NOVOS CONHECIMENTOS |
|
|
|
Prezado(a) Estudante,
Prezado(a) Professor(a),
Avaliar neste programa é mais do que verificar
o que foi aprendido. Sempre que possível é utilizar
conhecimentos que foram construídos durante as vivências,
e utilizá-los na solução de novos problemas.
Isso significa que o momento da Avaliação
é particularmente importante, também para o aprendizado
de novos conhecimentos e descobertas - na verdade um convite para
percorrer caminhos de interesse e de significado dentro do tema
estudado.
Para você que pretende prestar um exame vestibular, um concurso
público, ou mesmo aprofundar seus conhecimentos em uma área,
tema ou assunto será preciso ampliar a dinâmica desta
Avaliação. Por isso são sugeridos outros links,
contemplando problemas do Exame Nacional do Ensino Médio
(ENEM), Vestibulares de diversas universidades do país e
outras fontes.
Lembre-se que por mais que possamos auxiliá-lo em seus estudos,
a diferença final está em suas mãos. Por isso
acredite: um mundo novo está por ser descoberto ou, melhor:
inventado! Aceite esse desafio, construindo a cada dia sua carreira,
com planos de futuro, dedicação e ética.
Quando quiser saber se a resposta dada a um problema foi adequada,
suficiente e/ou correta, clique no botão  Gestão de Erros e compare resultados, encontrando
sugestões e dicas para avançar.
Gestão de Erros e compare resultados, encontrando
sugestões e dicas para avançar.
Como diria o Professor Galileo Lattes:
Vamos nessa, Brasil!
PROBLEMAS,
DESAFIOS E DICAS
As situações desafiadoras apresentadas através
dos problemas a seguir deverão contar com os recursos dos simuladores
e animadores disponíveis no Laboratório Virtual, para
serem investigadas. Caso necessite de outras informações,
visite: TEORIA, MAPA INTERATIVO e HISTÓRIA & TECNOLOGIA.
|
1. |
Problema:
Vamos utilizar o Laboratório Virtual para determinar
os comprimentos de onda das linhas visíveis do
espectro de gases monoatômicos. O simulador apresenta
os espectros de três elementos: Hidrogênio,
Hélio e Mercúrio.
O espectro de cada elemento será observado no
simulador através de um espectroscópio
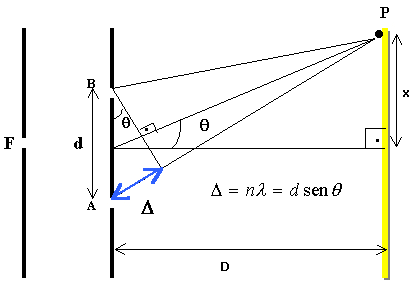
de rede de difração. A figura abaixo mostra
um esquema do caminho da luz a partir da fonte F que
contém o gás emissor de luz. As ondas
luminosas oriundas da fonte F atravessam a rede cujas
fendas são espaçadas de uma distância
d, e espalham-se sobre o anteparo a uma distância
D de acordo com a Lei de Young para a interferência
de luz.
|
 |
De acordo com a lei, para que uma interferência
construtiva ocorra no ponto P, isto é, para
que uma linha de determinada cor do espectro apareça
no ponto P, é necessário que
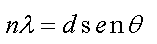
onde n é um número inteiro
maior que 1 que indica a ordem do espectro (já
que o espectro aparece repetidas vezes no anteparo)
e q
é o ângulo de espalhamento em relação
ao feixe incidente. A distância d entre as fendas
da rede de difração é obtida
a partir da informação referente ao
número de fendas por unidade de comprimento.
O simulador disponibiliza duas redes: uma com 300
fendas por milímetro e outra com 600 fendas
por milímetro. Então, em cada caso,
basta fazer:

Na figura anterior, é possível
perceber que o seno do ângulo de espalhamento
é calculado fazendo
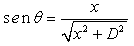
Portanto, ao observar o espectro, será
necessário determinar a posição
x de cada linha do espectro projetada na régua.
Observe no simulador, que o zero da régua coincide
com a posição da fonte.
A tabela a seguir apresenta os comprimentos de onda
tabelados das linhas visíveis destes três
elementos (1 Ao=10-10 m).
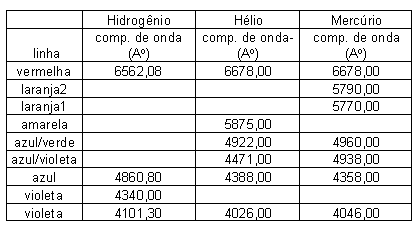
1.1 Para determinar os comprimentos
de onda do Hidrogênio usando o simulador, execute
as seguintes atividades:
a) escolha o gás Hidrogênio;
b) escolha a rede de difração de 300
fendas por mm;
c) posicione a rede de difração a uma
distância D da fonte de luz e anote este valor;
d) ligue a fonte e observe as linhas do espectro projetadas
na régua;
e) faça a medição da distância
x entre cada uma das linhas e a fonte (x=0) e anote
os valores numa tabela indicando a cor correspondente;
f) calcule o comprimento de onda de cada cor fazendo
n=1 na Lei de Young.
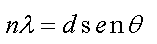
onde
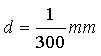
Cuidado com as conversões de
unidades de medida! Procure converter as unidades
de comprimento para metro e lembre-se que 1 angstron
(Ao) corresponde a 10-10 m.
g) Compare os resultados obtidos com a tabela de comprimentos
de onda catalogados para o Hidrogênio.
h) Repita todo o procedimento alterando a rede de
difração para 600 fendas por mm e compare
novamente os resultados.
|
|
|
1.2 |
Problema: Para determinar os
comprimentos de onda do Hélio usando o simulador, repita
as atividades de a até h
e compare os resultados obtidos com a tabela de comprimentos
de onda catalogados para o Hélio.
|
 |
|
|
|
1.3 |
Problema:
Para determinar os comprimentos de onda do Mercúrio
usando o simulador, repita as atividades de a
até h e compare os resultados obtidos
com a tabela de comprimentos de onda catalogados para o Mercúrio.
|
 |
|
|
DESAFIOS
A seguir, são apresentadas situações que objetivam
contribuir para o aprofundamento dos temas estudados, ampliando o
leque de aprendizagem. Procure resolver cada um dos desafios propostos,
verificando as margens de acerto através da gestão de
erros  . .
|
4. |
Desafio:
(ITA 2002) Sabendo que um fóton de energia 10,19
eV excitou o átomo de hidrogênio do estado fundamental
(n=1) até o estado p, qual deve ser o valor de p? Justifique. |
 |
|
| |
|
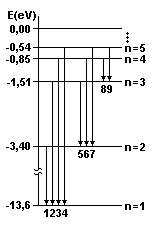
5. |
Desafio:
(UFC 2003) Na figura a seguir, as flechas numeradas
de 1 até 9 representam transições possíveis
de ocorrer entre alguns níveis de energia do átomo
de hidrogênio, de acordo com o modelo de Bohr. Para ocorrer
uma transição, o átomo emite (ou absorve)
um fóton cuja energia (hc/l)
é igual a |DE| (h
é a constante de Planck, c é a velocidade da luz
no vácuo, l é
o comprimento de onda do fóton e DE
é a diferença de energia entre os dois níveis
envolvidos na transição). Suponha que o átomo
emite os fótons X e Y, cujos comprimentos de onda são,
respectivamente,
lx = 1,03 x 10-7 m e ly
= 4,85 x 10-7 m. Quais são as transições
corretamente associadas às emissões desses dois
fótons (use h = 4,13 x 10-15 eV.s e c = 3,0 x 108 m/s)?
|
 |
|
|
|
|
6. |
Desafio:
ITA - 2003) Utilizando o modelo de Bohr para o átomo,
calcule o número aproximado de revoluções
efetuadas por um elétron no primeiro estado excitado
do átomo de hidrogênio, se o tempo de vida do elétron,
nesse estado excitado, é de 10-8 s. São dados:
o raio da órbita do estado fundamental é de 5,3
x 10-11 m e a velocidade do elétron nesta órbita
é de 2,2 x 106 m/s .
|
 |
|
|
a) 1 x 106 revoluções.
b) 4 x 107 revoluções.
c) 5 x 107 revoluções.
d) 8 x 106 revoluções.
e) 9 x 106 revoluções.
|
QUESTÕES
DE VESTIBULAR
|
1. |
Vestibular:
(UFRS - 2002) Os modelos atômicos anteriores
ao modelo de Bohr, baseados em conceitos da física clássica,
não explicavam o espectro de raias observado na análise
espectroscópica dos elementos químicos. Por exemplo,
o espectro visível do átomo de hidrogênio
- que possui apenas um elétron - consiste de quatro raias
distintas, de frequências bem definidas.
No modelo que Bohr propôs para o átomo de hidrogênio,
o espectro de raias de diferentes frequências é
explicado:
|
 |
a)
pelo caráter contínuo dos níveis de energia
do átomo de hidrogênio.
b) pelo caráter discreto dos níveis de energia
do átomo de hidrogênio.
c) pela captura de três outros elétrons pelo
átomo de hidrogênio.
d) pela presença de quatro isótopos diferentes
numa amostra comum de hidrogênio.
e) pelo movimento em espiral do elétron em direção
ao núcleo do átomo de hidrogênio.
|
|
2. |
Vestibular:
(PUCRS) Um átomo excitado emite energia, muitas
vezes em forma de luz visível, porque:
|
 |
|
|
a) um de seus elétrons foi arrancado do átomo.
b) um dos elétrons desloca-se para níveis de
energia mais baixos, aproximando-se do núcleo.
c) um dos elétrons desloca-se para níveis de
energia mais altos, afastando-se do núcleo.
d) os elétrons permanecem estacionários em seus
níveis de energia.
e ) os elétrons se transformam em luz, segundo Einstein.
|
|
|
3. |
Vestibular:
(UFRS - 2002) O decaimento de um átomo, de
um nível de energia excitado para um nível de
energia mais baixo, ocorre com a emissão simultânea
de radiação eletromagnética.
A esse respeito, considere as seguintes afirmações:
I - A intensidade da radiação emitida é
diretamente proporcional à diferença de energia
entre os níveis inicial e final envolvidos.
II - A freqüência da radiação emitida
é diretamente proporcional à diferença
de energia entre os níveis inicial e final envolvidos.
III - O comprimento de onda da radiação emitida
é inversamente proporcional à diferença
de energia entre os níveis inicial e final envolvidos.
Quais estão corretas?
|
 |
|
a)
Apenas I.
b) Apenas II.
c) Apenas I e III.
d) Apenas II e III.
e) I, II e III.
|
|
|
4. |
Vestibular:
(UFRN - 2003) A natureza do processo de geração
da luz é um fenômeno essencialmente quântico.
De todo o espectro das ondas eletromagnéticas, sabemos que
a luz visível é a parte desse espectro detectada pelo
olho humano. No cotidiano, vemos muitas fontes de luz BRANCA, como
o Sol e as lâmpadas incandescentes que temos em casa. Já
uma luz VERMELHA monocromática - por exemplo, de um laser
- temos menos oportunidade de ver. Esse tipo de luz laser pode ser
observado tanto em consultório de dentistas quanto em leituras
de códigos de barras nos bancos e supermercados. Nos exemplos
citados, envolvendo luz branca e luz vermelha, muitos átomos
participam do processo de geração de luz.
Com base na compreensão dos processos de geração
de luz, podemos dizer que:
|
 |
|
a)
a luz vermelha monocromática é gerada pelo decaimento
simultâneo de vários elétrons entre um mesmo
par de níveis atômicos.
b) a luz branca é gerada pelo decaimento simultâneo
de vários elétrons entre um mesmo par de níveis
atômicos.
c) a luz vermelha monocromática é gerada pelo decaimento
simultâneo de vários elétrons entre vários
pares de níveis atômicos.
d) a luz branca é gerada pelo decaimento sucessivo de um
elétron entre vários pares de níveis atômicos.
|
|
5. |
Vestibular:
(UFRS - 2004) Um átomo de hidrogênio tem sua
energia quantizada em níveis de energia (En), cujo valor
genérico é dado pela expressão En = -Eo/n2,
sendo n igual a 1, 2, 3, ... e Eo igual à energia do estado
fundamental (que corresponde a n = 1).
Supondo-se que o átomo passe do estado fundamental para o
terceiro nível excitado (n = 4), a energia do fóton
necessário para provocar essa transição é:
|
 |
|
a)
1/16 Eo.
b) 1/4 Eo.
c) 1/2 Eo.
d) 15/16 Eo.
e) 17/16 Eo.
|
|