|
|
1. O QUE É TEMPERATURA? Suponha que você tenha dois objetos em temperaturas
diferentes. Pode ser que seja possível avaliar qual está
numa temperatura mais elevada utilizando o tato. Essa seria uma
avaliação qualitativa do problema.
|
Calor é uma forma de energia em trânsito. Ela aparece quando existe uma diferença de temperatura entre dois corpos. Portanto, o calor é medido nas unidades usuais de energia, como o Joule (J) ou caloria (cal) e os seus múltiplos. 1 cal = 4,186 J (1) As substâncias apresentam-se na natureza
em diferentes estados
físicos. Podemos considerar como os estados mais
comuns na natureza: sólido, líquido e gasoso. Em estudos
mais avançados da Física, são também
estudados o plasma
e o condensado
de Bose-Einstein.
Figura 1: O diagrama mostra
a nomenclatura utilizada para definir as transições
entre as fases sólida, líquida e gasosa das substâncias. 1.3 Capacidade térmica Suponha que estamos fornecendo a mesma quantidade
de calor a dois corpos, compostos por substâncias diferentes.
Depois de um certo tempo, cada um apresentará um incremento
de temperatura diferenciado. Essa situação evidencia
que diferentes substâncias possuem diferentes comportamentos
térmicos. Mesmo que os corpos sejam feitos de um mesmo material,
eles podem ter capacidades térmicas diferentes, desde que
suas massas sejam diferentes. C = DQ / Dt (2) Podemos observar pela relação que, quanto maior for
a capacidade térmica do corpo, maior deverá ser a
quantidade de calor a ser fornecida para provocar uma determinada
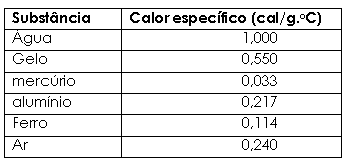
elevação de temperatura da substância. 1.3.1 Calor específico c = C / m (3) Portanto, o calor específico é uma
característica absoluta de cada substância.
Para massas de água,
que tem calor específico relativamente alto, observamos a
ocorrência de diversos fenômenos relacionados ao clima.
Mares, lagos e rios, que concentram grande quantidade de água,
acabam regulando a temperatura nas suas regiões de entorno.
Durante o dia, a água absorve grande quantidade de calor,
mas aquece-se pouco. Quando anoitece, ela libera calor para o entorno,
esfriando devagar. Uma consequência disso é que locais
próximos aos mares e lagos tendem a ter pequena amplitude
térmica (diferença entre a temperatura máxima
do dia e mínima da noite). Isso é verificado, por
exemplo, nas cidades do litoral brasileiro. Também a direção
das brisas costeiras é definida a partir da contribuição
desse fenômeno. 1.3.2 Calor sensível
e calor latente L = Q / m ® Q = m . L (4) Observe os valores de calor latente para a água:
Vamos tomar como exemplo o calor latente de fusão
do gelo, que é igual a 80 cal/g. Isso quer dizer que cada
grama de gelo (1 grama de gelo) necessita receber 80 calorias para
mudar seu estado físico, passando de gelo a 0oC
para água a 0oC. Essa é a lógica
que rege a indicação de valores para a tabela de calor
latente vista acima, e cada substância terá seus valores
específicos. 1.3.3 Equação
Fundamental da Calorimetria Q = m . c . Dt (5) Nas situações em que a temperatura final é maior do que a temperatura inicial, temos Q positivo, pois houve fornecimento de calor. Quando ocorre um resfriamento da substância, o sinal de Q será negativo. 1.3.4 Curvas de aquecimento
e resfriamento
|